摘要:本研究整合单细胞RNA测序与空间转录组学技术,系统解析了DMBT1糖蛋白在结肠癌前病变中的表达特征及其调控机制。研究发现,DMBT1在结肠异型增生病灶中特异性下调,且该现象与WNT信号通路的异常激活密切相关。通过多模型验证及人类样本分析,进一步确认DMBT1表达缺失是结肠异型增生进程中一个保守且关键的分子事件。

一、艰难梭菌定植促进Apc突变小鼠结肠独特细胞类型及状态扩增
为探究艰难梭菌在结直肠癌发生中的促进作用及其细胞与分子基础,本研究在前期发现人类结直肠癌相关生物膜来源的艰难梭菌可加剧Apc基因突变小鼠远端结肠腺瘤形成的基础上,进一步开展机制解析。研究采用无菌Apc突变小鼠模型,于8周龄时经口服灌胃分别构建两组实验体系:实验组接受包含29种细菌的人工联合菌群及艰难梭菌定植,对照组仅接受相同联合菌群而不含艰难梭菌。定植两周后,分别采集结肠组织进行单细胞RNA测序与基于石蜡切片的空间转录组学分析。
通过UMAP降维分析,研究首先对结肠上皮细胞群体进行无监督聚类及类型注释,揭示不同细胞簇间的转录相似性及谱系归属(图1C)。为评估各细胞亚群的干细胞样潜能,研究采用CytoTRACE算法,基于各细胞转录本多样本水平进行预测。结果显示,除经典的干细胞与过渡扩增细胞外,吸收性前体细胞2亚群亦呈现较高的CytoTRACE评分,提示其具备类似干细胞的转录特征。相反,终末分化细胞类型如杯状细胞与成熟吸收细胞(Abs1)该评分显著较低,显示其干细胞潜能已大幅下降。
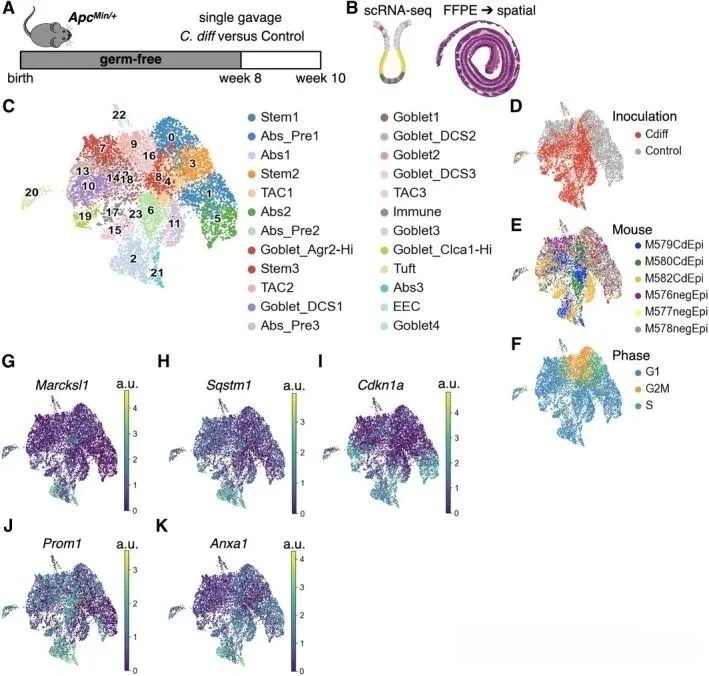
为进一步比较艰难梭菌定植对细胞组成的影响,研究将功能相近细胞簇进行合并,并对比两组间的比例差异。结果表明,相较于对照组,艰难梭菌定植组中前体细胞、杯状细胞、深部隐窝分泌细胞及干细胞的相对丰度显著升高。值得注意的是,杯状细胞内部呈现明显的转录状态分异:Agr2高表达杯状细胞主要集中于对照组,而Clca1高表达杯状细胞则在艰难梭菌定植组中占据主导。此外,基于细胞周期相关基因表达特征的UMAP投影揭示了增殖活跃细胞亚群的空间分布格局(图1F)。
为深入解析各细胞亚群在病理状态下的功能状态,研究进一步检测多个关键状态标志基因的表达模式,包括MARCKSL1(胎儿/胚胎重编程)、SQSTM1(自噬)、CDKN1A(衰老)、PROM1(异型增生启动)及ANXA1(再生性干性)(图1G–K)。分析发现,艰难梭菌定植组中一个独特的吸收细胞亚群(Abs3,对应图1C中的簇21)显著富集上述标志基因,提示该细胞亚群可能处于响应组织损伤的状态,并具备向异型增生转化的易感性。该发现为理解艰难梭菌相关促瘤微环境中细胞异质性及转化起始机制提供了新的线索。
二、吸收性结肠细胞差异基因表达揭示免疫活性增强及Dmbt1上调
为明确驱动细胞亚群状态转变及功能重塑的分子特征,研究进一步对各细胞类型内部进行艰难梭菌定植组与对照组的差异基因表达分析(图2A)。结果显示,Dmbt1在艰难梭菌定植组中呈现全细胞类型显著上调,为差异最显著的基因之一。鉴于Dmbt1兼具病原相关分子模式受体功能及诱导上皮分化的双重作用,研究将其作为细菌相关异型增生进程中的候选功能基因予以重点关注。
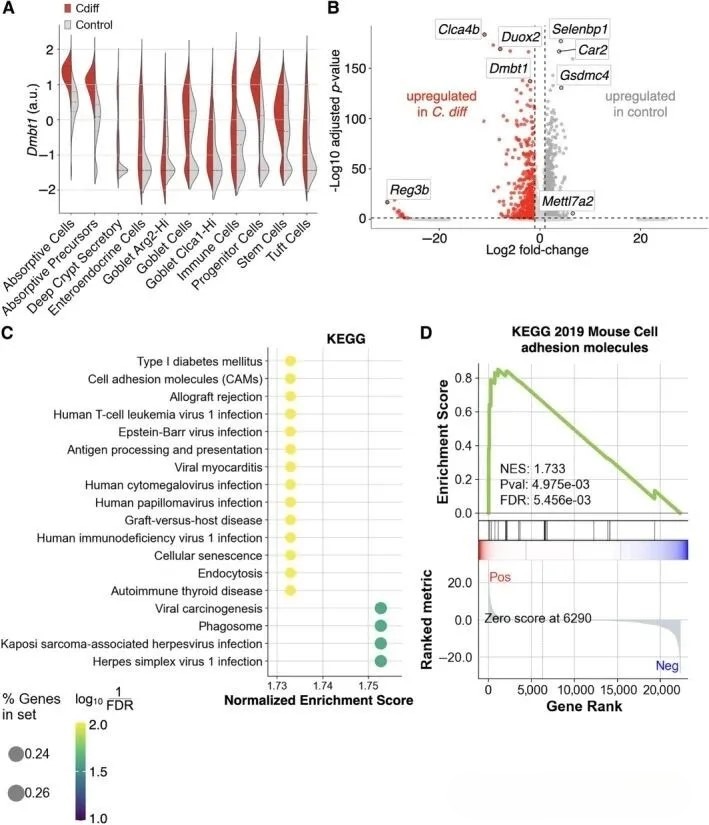
表达谱分析显示,Dmbt1在艰难梭菌定植组的所有上皮细胞类型中均呈一致性上调,其中以吸收细胞及其前体细胞中表达水平最高(图2A、B)。为进一步解析吸收细胞功能状态改变的分子基础,研究对该细胞群体进行基因集富集分析,发现细胞黏附与免疫应答相关通路显著富集(图2C、D),上述通路异常活化已被证实与结肠异型增生进程密切相关。类似的功能富集趋势亦在吸收性前体细胞及深部隐窝分泌细胞中观察到,提示艰难梭菌定植可能诱导跨细胞谱系的共性免疫重塑。
在杯状细胞谱系中,尽管Dmbt1表达水平在两组间差异不显著,研究仍进一步探讨不同杯状细胞亚型在早期肿瘤发生中的潜在贡献。通过比较Clca1高表达与Agr2高表达杯状细胞的转录组特征,发现前者显著富集免疫反应、细胞衰老及病毒致癌相关通路。同时,Clca1高表达杯状细胞中经典杯状细胞标志基因(Mxd1、Zg16、Tff3)表达水平明显升高,并伴有Duox2高表达。Duox2作为上皮来源活性氧生成酶,其上调提示该亚群可能具备哨兵杯状细胞样功能表型,参与黏膜免疫监视与损伤应答。
三、空间转录组学揭示DMBT1在结肠异型增生上皮中显著下调
鉴于前期研究发现艰难梭菌定植后最早于第2周即可检出异型增生病灶,本研究选取该时间点开展空间转录组学分析,以解析异型增生相关转录特征。单细胞RNA测序因异型增生细胞丰度较低,难以与干细胞或增殖细胞群体有效区分,因而无法直接识别该类细胞。为克服此局限,空间转录组学聚焦于异型增生病灶及其邻近正常组织区域,以实现区域特异性转录谱比较。
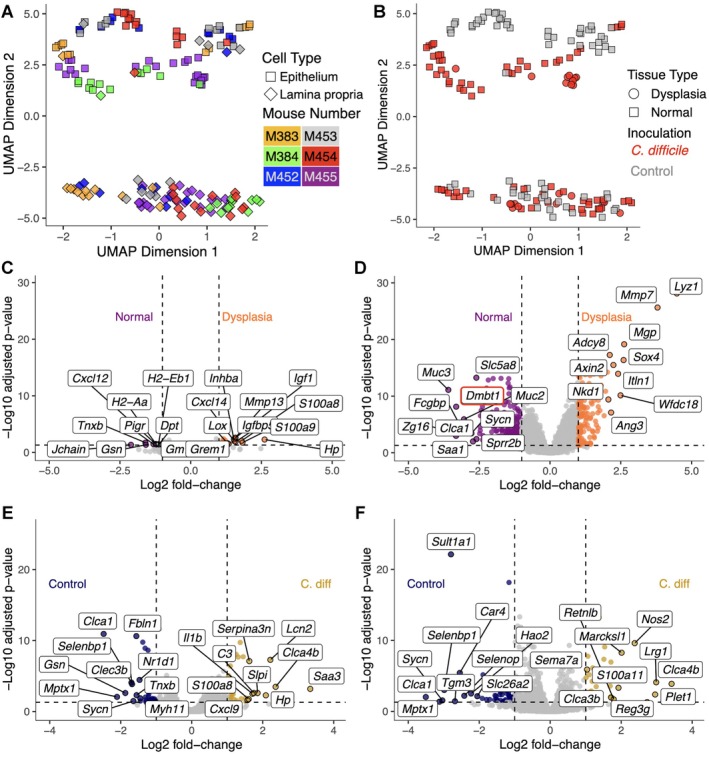
研究重复了前述动物实验模型,仅在同时接受29种联合菌群与艰难梭菌定植的小鼠中观测到结肠异型增生病灶,其发生率与既往报道一致。在组织切片中,依据组织学特征分别勾取上皮层与固有层区域作为独立感兴趣区进行空间转录组捕获。通过降维分析构建UMAP投影,无监督展示所有片段的转录组相似性分布格局,明确异型增生相关片段与非病变片段间的分离趋势(图3A、B)。
比较异型增生上皮与邻近正常上皮的差异表达谱显示,异型增生区域呈现WNT信号通路激活特征,表现为Nkd1与Axin2表达显著上调(图3D)。与此同时,异型增生相关固有层片段中富集多种肿瘤相关基质基因,包括Cxcl14、Igf1及Mmp13等(图3C)。值得注意的是,Dmbt1在异型增生上皮中呈现显著下调,为差异最显著的基因之一(图3D)。该发现与单细胞转录组中观察到的Dmbt1在全上皮谱系中的一致性上调趋势相反,提示Dmbt1表达动态可能具有细胞状态与病理阶段的特异性。
进一步对比艰难梭菌定植组与对照组在非病变区域的区域转录特征,结果显示定植组固有层片段中炎症相关基因(如Lcn2)表达升高,上皮片段中活性氧生成相关基因(如Nos2)亦明显上调(图3E、F)。综上,空间转录组学数据既验证了单细胞测序所揭示的全局性转录重塑趋势,亦独立鉴定出一组在异型增生病灶中特异性失调的基因特征,为理解艰难梭菌相关肿瘤早期发生过程中上皮-微环境交互作用提供了空间定位维度的分子依据。
四、多组学整合分析揭示艰难梭菌相关异型增生的分子特征与候选通路
为整合单细胞与空间转录组学数据集的互补优势,本研究构建了跨平台联合分析策略。空间转录组学可在原位组织背景下精准界定异型增生病灶,而单细胞转录组学则提供更高的基因表达解析度。研究首先基于空间转录组学数据筛选异型增生上皮相较于正常组织的显著上调基因(|log₂倍数变化|>1,校正后p<0.05),据此构建异型增生评分体系,并投射至单细胞转录组数据集。结果显示,干细胞群体在该评分体系中得分最高,提示其与异型增生转录特征高度相关。
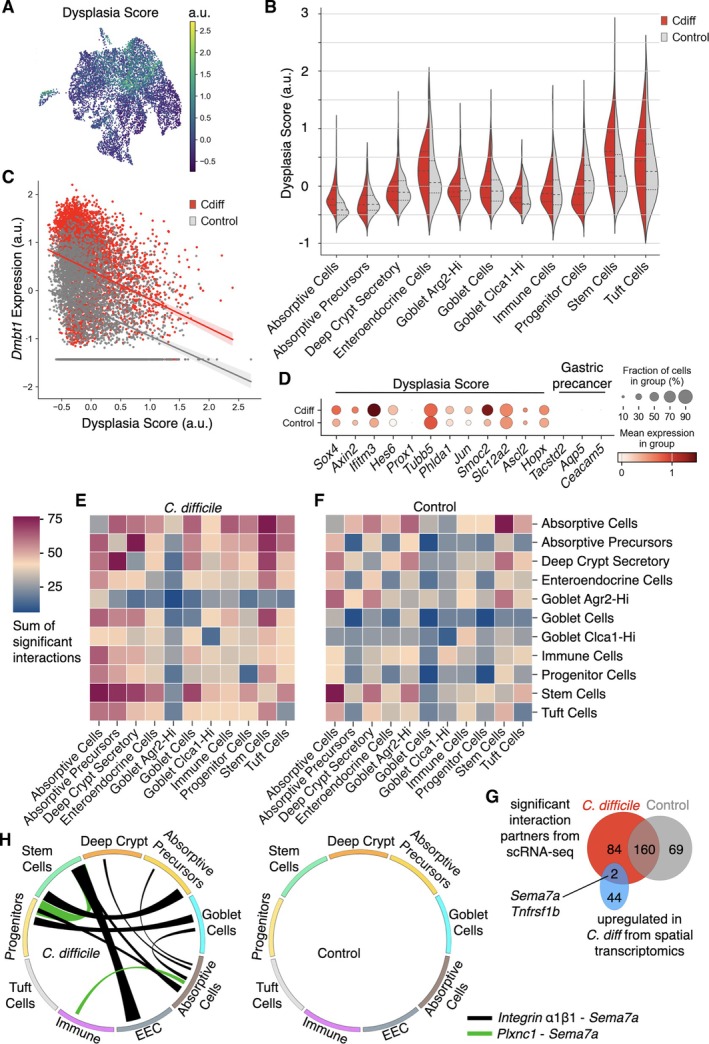
为进一步提升信号特异性,研究将基因集精简为仅在干细胞亚群中一致性高表达的12个基因,包括Sox4、Axin2、Ifitm3、Hes6、Prox1、Tubb5、Phlda1、Jun、Smoc2、Slc12a2、Ascl2及Hopx。优化后的异型增生评分表现出更佳的信噪比,且在艰难梭菌定植组细胞中达到峰值(图4A、B)。值得注意的是,肠内分泌细胞与簇状细胞亦呈现较高评分,提示这些罕见上皮亚型可能同样参与异型增生相关转录重塑。
在单细胞数据集中,异型增生评分与Dmbt1表达水平呈负相关(图4C)。图4D展示了12个标志基因在干细胞中的差异表达情形,其中Sox4、Ifitm3与Smoc2为艰难梭菌定植组干细胞中最显著上调基因,既往研究已证实上述分子参与结直肠癌相关致癌信号通路。尽管DMBT1在胃癌前病变及痉挛性多肽表达化生中表达上调,本研究未在异型增生上皮中检测到Tacstd2、Aqp5及Ceacam5等胃型化生/异型增生标志基因的表达(图4D)。综上,Dmbt1在艰难梭菌定植早期呈广泛诱导,而至异型增生阶段则表达受抑,这一表达切换构成两大转录组数据集交汇的核心发现之一。
为进一步提升细胞间相互作用推测的空间可信度,研究基于高分辨率单细胞转录组数据,采用CellPhoneDB平台分别构建艰难梭菌定植组与对照组的配体-受体互作网络(图4E、F)。通过组间比较,共筛选出84对在定植组中特异性富集、在对照组中不显著的互作关系(图4G,红色标示)。为验证其空间定位相关性,进一步在空间转录组学上皮片段中回溯上述互作基因的表达特征,最终鉴定出Semaphorin 7a(Sema7a)与肿瘤坏死因子受体超家族成员1b(Tnfrsf1b)作为跨平台共同显著基因(图4G,蓝色标示)。CellPhoneDB预测显示,Sema7a的潜在互作伙伴为整合素α1β1及丛状蛋白C1(Plxnc1),该配体-受体对仅存在于艰难梭菌定植组互作网络中,对照组未见显著富集(图4H)。上述跨平台验证策略为Sema7a介导的信号轴在艰难梭菌相关结肠肿瘤发生中的作用提供了空间定位与分子互作双重维度的证据支持。
五、多模型验证揭示Dmbt1下调为小鼠结肠异型增生的共同分子特征
为验证异型增生相关Dmbt1下调现象的普适性并探索其潜在机制,本研究进一步对多个独立小鼠结肠肿瘤发生模型开展转录与蛋白水平的整合分析。
研究首先对已发表的促肿瘤性浆液与对照浆液接种小鼠的结肠单细胞转录组数据进行再分析。促肿瘤性浆液包含艰难梭菌,其处理组结肠分化上皮细胞中Dmbt1表达水平显著升高(图5A)。该结果与本研究基于29种菌群联合艰难梭菌定植模型所观察到的全上皮谱系Dmbt1上调趋势高度一致(图2A),进一步确证艰难梭菌相关定植早期阶段Dmbt1的广泛诱导现象。
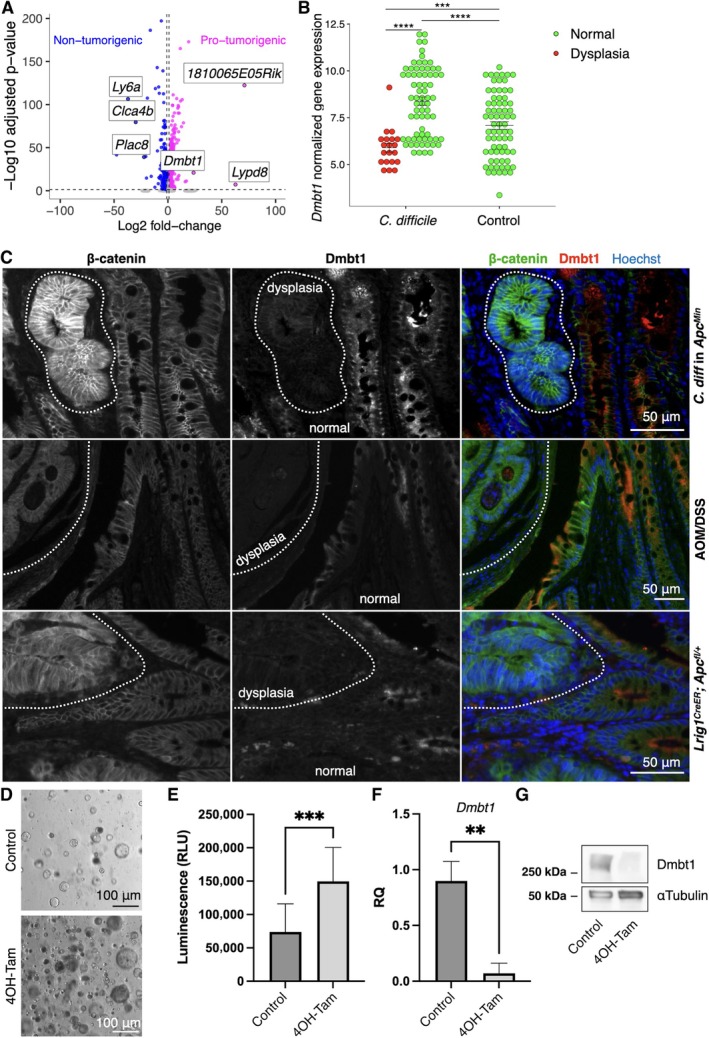
继而,研究在原联合菌群定植模型的空间转录组数据中对Dmbt1表达进行区域特异性解析。结果显示,艰难梭菌定植组异型增生上皮片段的Dmbt1表达水平显著低于同组及对照组的正常上皮区域(图5B)。值得注意的是,定植组正常区域上皮中Dmbt1表达仍显著高于对照组正常组织,与胃肠道感染背景下Dmbt1上调的已知特征相吻合。上述发现进一步明确了Dmbt1在感染应激与异型增生转化两个阶段呈现表达切换的动态特征。
为评估该下调表型是否超越特定菌群干预模型而具有普遍性,研究进一步采用免疫荧光技术检测两个独立的结肠肿瘤发生模型——氧化偶氮甲烷联合右旋糖酐硫酸钠诱导的结肠炎相关癌模型,以及Lrig1突变转基因小鼠模型。结果显示,在两模型中异型增生上皮均呈现Dmbt1蛋白水平的显著降低,且该下调与β-连环蛋白的核积聚区域呈现负向空间关联(图5C)。鉴于β-连环蛋白系WNT信号通路活化的可靠标志物,上述结果提示Dmbt1下调可能与WNT信号异常激活密切相关,并可能构成小鼠结肠异型增生进程中相对保守的分子事件。
为深入探究Dmbt1下调的分子机制,研究基于Lrig1突变Apc小鼠来源的结肠组织构建类器官模型。该模型于Apc杂合性缺失背景下自发出现异型增生特征。研究假设Apc双等位基因功能丧失所驱动的WNT信号过度激活可能是Dmbt1表达受抑的上游事件。为验证此假说,采用4-羟基他莫西芬诱导类器官中Apc基因重组。结果显示,诱导组类器官形成效率及活力均显著高于未处理对照组(图5D、E)。进一步通过RT-qPCR与免疫印迹分析证实,Apc重组诱导可显著下调Dmbt1基因转录及蛋白表达水平(图5F、G)。上述发现表明,WNT信号通路的异常激活可直接介导Dmbt1表达抑制,为该基因在异型增生阶段的特异性下调提供了机制性解释。
六、人类结肠异型增生中DMBT1蛋白表达缺失的临床验证
为明确DMBT1表达下调是否在人类结肠肿瘤发生过程中同样存在,本研究首先利用已发表的癌前结肠息肉多组学图谱数据,对腺瘤相关细胞亚群中DMBT1的转录特征进行系统分析。数据显示,在分化型隐窝顶端细胞中DMBT1表达水平较高,而腺瘤特异性细胞亚群中该基因的表达则显著下降(图6A–C)。尽管部分管状腺瘤的腺瘤特异性细胞仍可检测到DMBT1表达,但在伴有高度异型增生的管状绒毛状腺瘤中,其表达水平降至最低。进一步将隐窝顶端细胞与腺瘤特异性细胞中DMBT1的表达水平与经典WNT信号通路靶基因进行比较,发现二者呈现明显负相关(图6C),这与小鼠模型中β-连环蛋白积聚区域DMBT1表达下调的空间关联特征高度一致(图5C)。
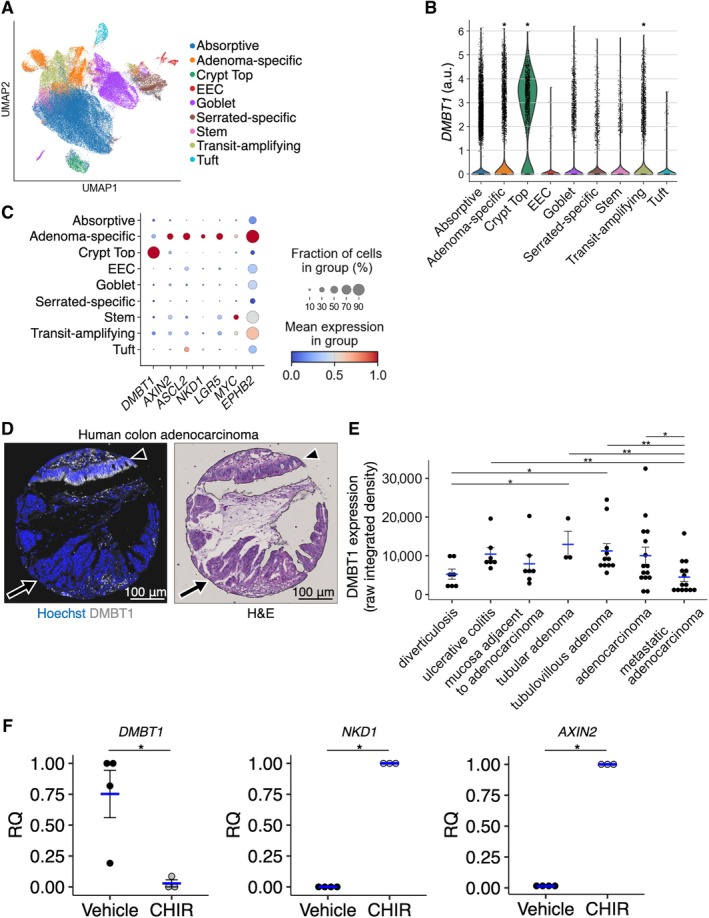
为进一步在蛋白水平验证上述发现,研究采用包含多种结肠病理状态的组织芯片,通过免疫荧光染色对DMBT1蛋白表达进行系统评估。芯片样本涵盖憩室病、溃疡性结肠炎、腺癌旁正常组织、管状腺瘤、管状绒毛状腺瘤、腺癌及转移性癌等多个组织类型(图6D、E)。定量分析显示,DMBT1蛋白表达水平在管状腺瘤及管状绒毛状腺瘤中相对较高,而至转移性腺癌阶段则显著下降,呈现进展阶段依赖性下调趋势(图6E)。
为探讨WNT信号通路活化是否直接介导DMBT1表达抑制,研究采用正常人结肠类器官模型,并使用GSK3β特异性抑制剂CHIR99021处理以激活WNT信号。结果显示,CHIR99021处理可显著上调经典WNT靶基因(如 NKD1、AXIN2)表达,同时伴随DMBT1 mRNA及蛋白水平的明显下降(图6F)。该结果与小鼠结肠类器官中Apc重组诱导DMBT1下调的表型相互印证,提示WNT信号通路异常活化对DMBT1的转录抑制在人与小鼠结肠上皮中具有保守性。
综上,结合人类临床样本与体外类器官模型,本研究证实DMBT1蛋白表达缺失是结肠腺瘤–腺癌进展过程中的阶段性分子事件,其下调机制至少部分由WNT信号通路异常激活所介导。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


