1、前言
Bradford 法(考马斯亮蓝法)是蛋白含量测定的经典实验方法,因其灵敏度优异,被实验室广泛使用。但操作细节把控不当,容易出现结果不稳定、重复性差等问题。
本文为你带来源自 Springer Protocol 的标准化实验方案,稳定好做、易上手。
2、实验原理
Bradford 法以考马斯亮蓝 G-250 为显色染料。
在酸性环境中,染料可与蛋白质中的碱性氨基酸(组氨酸、精氨酸、赖氨酸等)结合,形成染料 - 蛋白复合物,溶液颜色由棕黄色变为蓝色,可用分光光度计进行检测。
蛋白浓度越高,蓝色显色强度越高,通过吸光度即可定量计算蛋白含量。
该方法操作简便、快速、灵敏度高,受缓冲液成分干扰小,是蛋白定量的优选方法。
此法仍存在一定局限性:显色反应依赖蛋白质中的组氨酸、精氨酸、赖氨酸等碱性氨基酸。若待测蛋白中这类氨基酸含量与平均水平差异较大,会导致定量结果不准确。

3、实验材料
所需设备
- 移液器
- 玻璃比色皿
- 紫外分光光度计
试剂与耗材
- 考马斯亮蓝 G
- 100% 乙醇
- 磷酸
- BSA(标准品,用于绘制标准曲线)
- 稀释缓冲液
- 待测蛋白样品
- 超纯水
- Whatman 1 号滤纸
Bradford 试剂配制
- 将 40 mg 考马斯亮蓝 G 溶于 20 mL 100% 乙醇,搅拌 20 min;
- 依次加入 40 mL 磷酸与 340 mL 超纯水;
- 用 Whatman 1 号滤纸对混合液过滤 2 次;
- 滤液转入棕色瓶,4 ℃ 避光保存。
注:全程操作需避光。
4、实验步骤
蛋白样品建议按需分装,单次使用一管,冰上解冻。
- 用 BSA 配制 1–20 μg 梯度稀释的标准品,在 595 nm 波长下检测吸光度并绘制标准曲线(下文提供标准配制方案)。
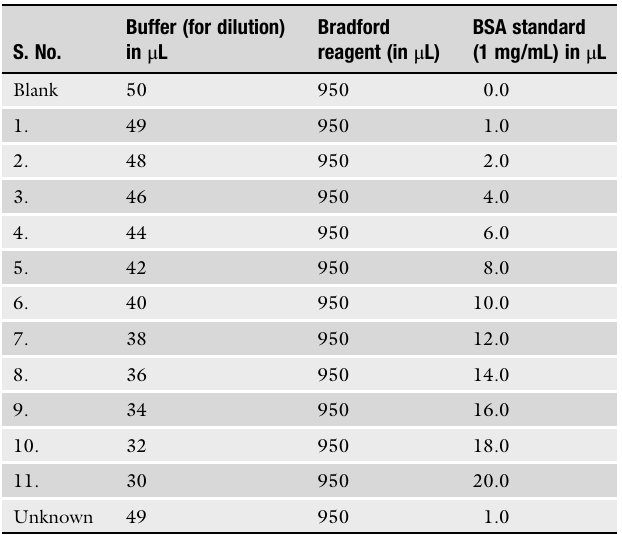
三列数据从左至右依次为:稀释缓冲液、Bradford 试剂、BSA 标准品。
- 根据已绘制的标准曲线,测定缓冲液与待测样品混合液在 595 nm 处的吸光度,对照标准曲线即可计算得到待测样品的蛋白浓度。
5、标准曲线绘制
以蛋白浓度(mg/mL)为 X 轴,595 nm 处吸光度(OD595)为 Y 轴,利用 BSA 标准品数据绘制标准曲线。为保证定量精度,建议对数据进行最优曲线拟合,示例见下图。
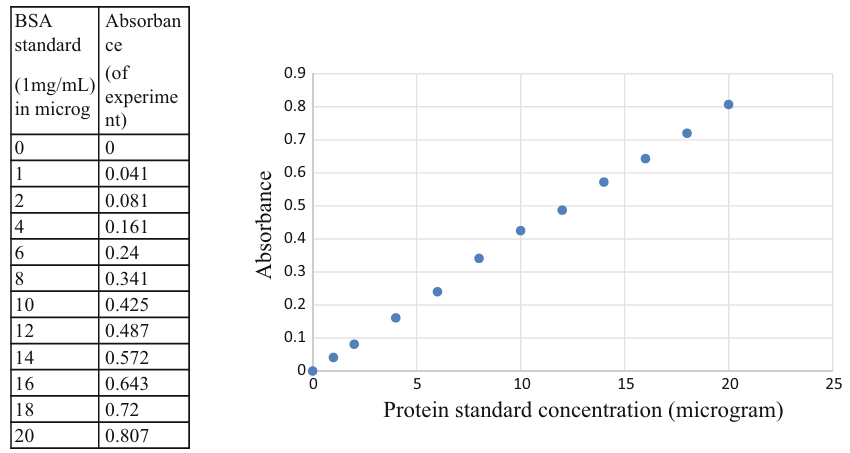
左侧为 BSA 标准品原始数据,右侧为基于该数据拟合得到的标准曲线。
6、注意事项
- Bradford 法灵敏度较高,适用于低浓度蛋白样本。若样品浓度超出检测线性范围,需先梯度稀释,使吸光度落在有效区间内再进行测定。
- 样品中含有的表面活性剂(如常见于总蛋白提取缓冲液)会对检测结果产生干扰,需尽量避免。
- 显色完成后应在 1 小时内完成吸光度检测,每组样品建议设置 3 个技术重复。
- 移液操作需精准规范。由于本法多用于低浓度蛋白定量,移液误差易导致结果波动,需严格控制操作一致性。
- 若待测蛋白中组氨酸、精氨酸、赖氨酸含量与常规蛋白平均水平差异较大,不建议使用 Bradford 法,可根据蛋白特性选择 Lowry 法、BCA 法或紫外分光光度法。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


